넘쳐나는 COVID-19 임상시험연구- 치료제개발 글러벌 협력 파이프라인 필요
-Flooded by the torrent: the COVID-19 drug pipeline-
미국 국립보건원 NIH ClinicalTrials.gov에 등록되어 진행하고 있는 COVID-19 관련 임상연구는 300여건 이상이고, 세계보건기구(WHO) 국제임상연구등록 플랫폼(World Health Organization's International Clinical Trials Registry Platform, WHO ICTRP)에서는 590건의 프로젝트가 현재 임상시험 프로젝트 수행 중에 있다. COVID-19 치료제 및 백신개발은 국내에서도 13개의 약물 개발이 진행 중에 있다. 온세계는 지금 COVID-19 치료법 개발을 위한 범람하는 홍수같이 급한 속도를 내고있지만 정말 이와 같이 엄청나게 많은 임상시험연구가 모두 필요할까?

(Source: The Lancet, 2020년 4월 18일, doi.org/10.1016/S0140-6736(20)30894-1)
영국 공중보건긴급지원팀장의 감염병전문가인 Daniel Bausch은 “COVID-19 치료제개발을 위해 300여건이상의 임상시험까지는 필요하지 않을 것이다” 라는 의견을 밝혔다.
한국의 COVID-19 치료제 및 백신 개발: 8개의 회사가 전임상 개발중
국내 회사에서 개발하는 약물의 경우 2개는 후보물질 연구단계에, 6가지는 전임상 단계에서 개발중에 있다.
셀트리온(Celltrion)이 개발하는 S-protein 조절자(modulator) 단일클론항체 경우 2020년 3분기에는 임상을 시작할 계획으로 알려져 있다.
이뮨메드(Immune Med)가 개발하는 키메릭 인간화된 바이러스 억제인자 (chimeric humanized virus suppressing factor)도 단일항체로서 2020년 2월에 COVID-19에 대한 전임상단계로 진입하였으며, 2020년 2월 COVID-19환자 대상으로 임상 진행을 MFDS로부터 승인받았다.
엔지켐 생명과학(Enzychem Life Science)에서는 모세디피모드(PLAG; mosedipimod)를 개발중이며, 임상 1상 진입을 2020년 3월에 계획하면서 미국, 중국, 한국에서 COVID-19에 대해 공동 개발 파트너 및 라이센싱 아웃 비전을 발표하였다.
코미팜(komipharm)의 경우 전립선암, 비호치킨 림프종, 뇌암, 전이성 폐암 등 11개의 암 분야에 대해 치료제로서 개발중이었던 일반합성의약품KML-001 약물을 COVID-19인 다른 적응증으로 개발한다고 발표하였다.
부광약품에서 COVID-19 치료제로 개발중인 Clevudine은 일반합성의약품으로서 hepatitis B virus 감염 치료제로서 국내 판매중이며, 2020년 3월 in vitro 실험데이터를 발표함으로써 COVID-19치료제로서 개발을 시작하였다.
이노비오 제약(Inovio pharmaceuticals)에서는 진원생명과학(geneone life science), 베이징 어드백신 바이오테크놀로지 (Beijing Advaccine Biotechnology)과 함께 미국, 중국, 한국에서 COVID-19 백신에 대해 개발하고 있으며 전임상 단계에서 연구 진행중을 확인된다.
제넥신과 바이넥스는 COVID-19 DNA 백신 GX-19 공동개발을 위해 상호 양해각서를 13일 체결하였고 전임상 단계의 개발을 현재 진행중입니다.
SK 바이오사이언스(SK Bioscience)는 COVID-19 후보물질을 도출하였고, 3월 23일 전임상단계 개발을 시작하였다.
COVID-19 약물의 전체 파이프 라인을 구축해야 할 이유
세계적으로 COVID 19 약물 개발단계를 살펴보면, 넘쳐나는 임상시험 프로젝트들 가운데 90%는 아직 승인조차 받지 못한 상태이고 일부 치료제로 인한 재정적 이익에 관심을 가지는 동기도 작용할 수 있다. 덧붙여 COVID-19의 과학적 이해도 너무 빠르게 변화되고 있으므로 다양한 옵션을 열어 두고 시작하는 것이 합리적이다. COVID-19의 급변하고 이해와 넘쳐나는 임상시험 상황을 종합적으로 코디네이션할 수 있는 메카니즘이 없이는 혼란이 야기될 수 있는 징후가 나타나고 있다. 노르웨이 연구위원회 존-아네로 팅겐 (John-Arne Røttingen) 위원장은 “너무 소규모의 임상시험들과 임상시험적용방식에 편차가 너무 크고, 많은 임상시험들이 실제 임상질문에 답변이 될 수 있는 형태로 설계되어 있지 않았고, 매우 소규모연구에서 유효한 것으로 나타났으나, 좀 더 규모크고 엄격한 설계로 디자인된 연구에서는 효과가 없음으로 나타났다” 밝혔다.
길리드(Gilead)의 의료책임자인 Merdad Parsey도 존-아네로 팅겐 (John-Arne Røttingen) 위원장의 의견에 동의하면서 “일부 치료제의 근거는 크지않고 이러한 약제가 얼마나 광범위하게 사용되는지를 고려할 때 실제로 다른 분자로 신호를 감지하는 능력에 영향을 줄 수 있음”을 밝혔다.

COVID-19 개발 분류
바이오의약품 68%, 일반합성 의약품 32%가 개발 중이며, 임상으로 진입한 8개의 약물 중 70%는 바이오 의약품, 30%는 일반합성 의약품으로 진행되고 있다. 또한 초기 연구의 경우도 유사하게 바이오 의약품과 일반합성 의약품 비율이 각각 68%, 32%로 바이오 의약품이 일반합성 의약품의 비율보다 많이 개발되고 있다.
COVID-19 개발 중인 약물
바이오의약품 중에서는 항체 개발이 29개로 가장 우세하고, 이 항체치료제는 10개의 다른 타겟에 대해 개발하고 있으며, 순차적으로 IL-6, 코로나 바이러스 Spike 당단백질 (Coronavirus spike glycoprotein), 보체 C5a factor, GM-CSF 리간드을 타겟으로 많이 개발하고 있습니다. 나노파티클, 리포좀 형태, 서방형 제제 개발 등 기술을 이용하여 효과적인 주입기법을 사용하는 개발형태 등이 나타나고 있다. 개발 중인 약물 중 18개는 다른 적응증으로 사용을 허가받은 치료제로서 기존 약물의 적응증 재창출 기법(Drug Repositioning)을 통해 백신 개발에 박차를 가하고 있다. 미국 FDA과 EMA에서도 COVID-19 사태의 심각성을 인정하며, COVID-19 개발 및 승인의 신속한 지원을 위한 대책을 발표하고 개발에서 승인에 이르는 속도가 더욱 빨라질 수 있도록 지원하고 있다.
한편 연구단체들은 어려운 딜레마에 직면했는데 새로운 사실을 반영할 수 있는 시간이 거의 없는 현실과, “한편으로는 이 일의 속도가 너무 빠르기 때문에 조정에 너무 많은 시간을 소비하고 싶지 않다” 면서 모두가 최선을 다해 진행하고 있음을 덧붙였다. 베이징에 위치하고 있는 중국-일본병원의 폐 및 중환자 치료전문가, 빈 카오 (Bin Cao)박사는 일차결과(Primary outcoime), 포함 및 배제범위(inclusion and exclusion criteria), 표준치료 기준에 대한 명시임을 밝혔다.
현재 2020년 4월 8일자로 임상단계의 약물은 Complement C5a factor inhibitor, IL-6 receptor antagonist, Moesin modulator, Basigin inhibitor, Heat shock protein inhibitor, Hepatitis C virus NS3 protease inhibitor, HIV-1 protease inhibitor, IL-6 receptor agonist, Interferon beta ligand, NK1 receptor antagonist, RNA polymerase inhibitor, RNA polymerase modulator등 12개의 주요 타겟에 대해 개발 중이며, 초기 연구 단계 약물의 경우 30개 이상 약물이 개발 중이며 그 효과성을 검사 중에 있다.
전세계의 COVID-19 환자를 등록함으로써, 연대 임상시험은 개별로 수행되는 크고 작은 독립시험보다 더 빨리 질문에 대답 할 수 있다. 이미 70 개국이 연대임상시험에 합류했다. 생명 공학 Brii BioSciences의 최고 책임자이자 GlaxoSmithKline의 전염병 연구 및 개발 책임자 인 Zhi Hong은 “연대 시험이 좋다고 생각하는데 설계는 비록 이중 맹검( double-blinded)이 아니지만 팬데믹 상황에서는 수용할 수 있는 설계임을 밝혔다. Zhi Hong은 가능한 한 많은 대상자를 등록함으로써이 데이터는 실제 효과를 훨씬 많이 반영 할 수 있는 가능성이 높다”고 덧붙였다.
클래리베이트가 제공하는 인공지능 약물개발 예측 모듈을 활용하여 실제로 COVID-19의 치료제와 백신은 언제 개발될 수 있는지 분석결과, 실제 AI 기능을 사용해서 도출한 시장화 시점과 성공개발 가능성은 약물의 마일스톤(milestone) 에 의해 머신러닝 기법으로 예측된 예방 백신과 치료제 개발 시점은 (4월 8일 자료기반으로) 아래와 같다.
Drug Timeline Success Rate (DTRS)코텔리티 인공지능 예측 모형
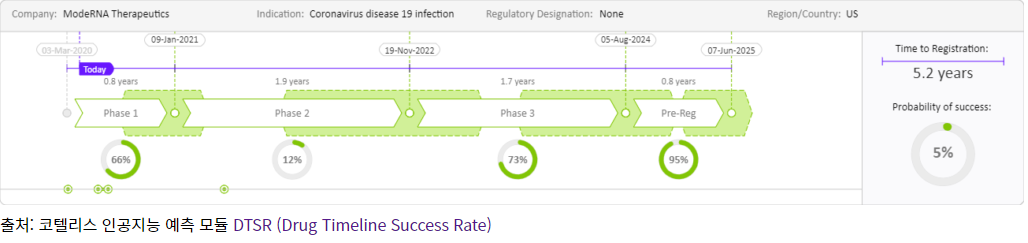
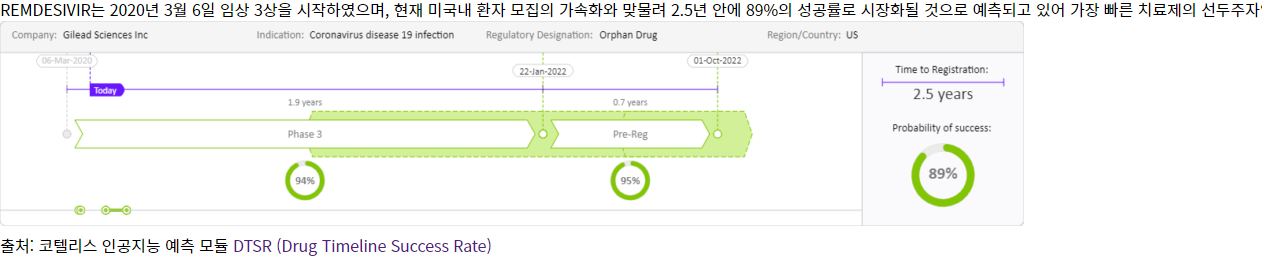
한편 코텔리스 인공지능 분석에 의학면 모더나 테라퓨틱스에서 개발 중인 백신 mRNA-1273개발은 2020년 3월에 임상 1상을 시작하여 10개월 이후 임상 1상 데이터 완료 후 임상 2상에 들어갈 것으로 예측되고, NIAID의 VRC(vaccine research center)와 협업하에 고안된 백신으로 2020년 전임상 데이터를 보고하여, 동물모델에서 예방효과가 입증된 후 2.5년에서 최종 5.2년의 시간이 경과할 것으로 예측하고 있다. 렘데시비르(Remdesivir)는 2020년 3월 6일 임상 3상을 시작하였으며, 현재 미국내 환자 모집의 가속화로 2.5년 안에 89%의 성공률로 예측되고 있어 가장 빠른 치료제의 선두주자로 나타났다.
렘데시비르(Remdesivir)의 치료제 개발 예방
크래리베이트(Clarivate)의 생명과학분야 코텔리티 빅데이터 AI를통하여 현재 개발 중인 COVID-19 치료제 및 백식 개발현황을 분석한 결과 개발 일정이 가장 빠르게 평가되고 있는 것은 미국의 모더나가 개발 중인 COVID-19 백신 ‘mRNA-1273’으로 5.2년이 상용화까지 소요될 수 있음을 보고했다. 반면 미국 길리어드개발 중인 COVID-19 치료제’ 렘데시비르(Remdesivir)는 상용화까지 2.5년이 소요될 수 있음으로 예측했으며, 대표적인 치료제 및 백신 개발 현황을 아래와 같이 발표했다.

[ A researcher conducts tests at the Moderna labs in Cambridge, Massachusetts.
Photograph: Boston Globe/Boston Globe via Getty Images]
▶ 치료제 현황
1. 클로로퀸(Chloroquine): 1949년 사노피가 말라리아 대상으로 개발된 약물로 현재 COVID-19에 대해 임상시험 진행 중임.
2. 렘데시비르(Remdesivir) : 길리어드 사이언스가 에볼라 바이러스 감염질환 대상으로 개발한 약물로 nucleoside RNA polymerase inhibitor로 COVID-19에 대해 FDA가 IND(전임상에서 임상으로 넘어가겠다고 하는 서류)를 승인하였고 NIAID (National Institute of Allergy and Infectious Diseases)의 지원하에 네브라스카 의과대학(University of Nebraska Medical Center, Omaha)에서 COVID-19대상으로 임상시험을 진행하고 있는 약물임.
3. 파비피라비르(Favipiravir): 후지필름 토야마 케미컬이 인플루엔자 대상으로 개발한 RNA polymerase inhibitor로서 COVID-19 환자대상으로 효과를 보이고 있으며, 중국정부에 의해 COVID-19 치료제로서 지원되고 있음.
4. 기타 치료제 개발현황 : Biopharma products in development for COVID-19 확인 가능함.
▶ 백신 개발 현황
1. mRNA-1273: 모더나(Moderna)와 협업을 통해 NIAID가 COVID-19 백신으로서 개발 중이며, NIAID에 의해 지원을 받고 있으며 KPWHRI (Kaiser Permanente Washington Health Research Institute)에서 임상 1상 진행중임.
2. LV-SMENP-DC: SAR-CoV-2 바이러스의 Spike 당단백질에 대한 백신으로서 Shenzhen Geno-Immune Medical Institute가 개발중이며, 임상 2상 진행중임.
3. INO-4800: INOVIO Pharmaceuticals가 COVID-19에 대해 백신 개발중이며, 2020년 초기에 전임상이 시작되었고 4월에 임상을 시작할 것으로 예상됨. CEPI로부터 $9 million, Bill & Melinda Gates Foundation으로부터 $5million을 지원받았고 개발 수행 중임.
WHO는 COVID-19 확진되어 입원한 환자를 위한 4 가지 치료 접근법에 대한 연구 연대를 통해 좀 더 큰 조정을 제공하기위한 조치를 취했다; 1) 길르앗의 RNA 폴리머 라제 억제제 렘 데시 비르(Gilead's RNA polymerase inhibitor remdesivir); 항 말라리아 히드 록시 클로로퀸 및 클로로퀸(the antimalarials hydroxychloroquine and chloroquine); 2) HIV 프로테아제 억제제 인로 피나 비르 및 리토나비르(HIV protease inhibitors lopinavir and ritonavir); 3) 로 피나 비르 및 리토 나 비어를 면역 조절제 인터페론 베타 -1a와 조합하여 구성된 치료(lopinavir and ritonavir in combination with the immunomodulatory agent interferon beta-1a). WHO 관계자들은 앞으로 12-16 주 안에 첫 번째 결과를 얻을 수 있을 것이라고 말했다.

의과학연구정보센터 제공
References
Flooded by the torrent: the COVID-19 drug pipeline, The Lancet, Vol 95, Issue 10232,, P1245-1246, APRIL 18, 2020, [바로가기]
FDA to expedite public release of guidance documents related to COVID-19 [바로가기]
The COVID-19 pandemic: European regulators respond [바로가기]
Cortellis Drug Timeline Success Rate [바로가기]
Biopharma products in development for COVID-19 [바로가기]
Clarivate Bigger Splash, Cortellis 코로나 백신과 치료제 개발 언제가능할까 [바로가기]